Bromure d'hydrogène

Cet article concerne le gaz bromure d'hydrogène. Pour des informations concernant le bromure d'hydrogène en solution, voir acide bromhydrique.

Pour les articles homonymes, voir HBr.
| Bromure d'hydrogène | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | Bromure d'hydrogène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 10035-10-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.030.090 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 233-113-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | gaz comprime liquefie, incolore, d'odeur acre[1]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | HBr [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire[3] | 80,912 ± 0,001 g/mol H 1,25 %, Br 98,75 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dipolaire | 0,827 2 ± 0,000 3 D [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −87 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | −67 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | dans l'eau à 20 °C : 1 930 g·l-1[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
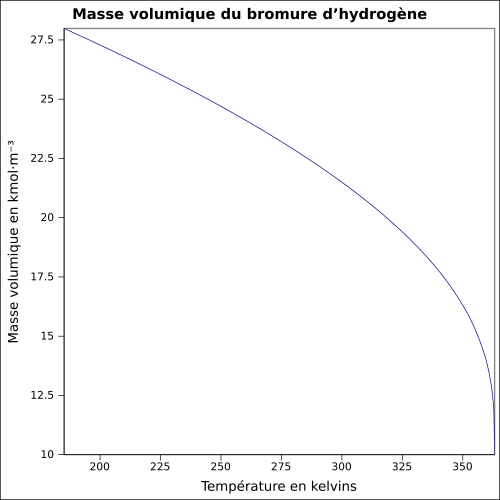
| Masse volumique | 1,8 g·cm-3[1] équation[4] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | à 20 °C : 2 445 kPa[1] équation[4] :
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 85,5 bar, 90,05 °C [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 200 m·s-1 (0 °C,1 atm)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S0gaz, 1 bar | 198,7 J/mol·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ΔfH0gaz | –36,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ΔvapH° | 12,69 kJ·mol-1 (1 atm, 25 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
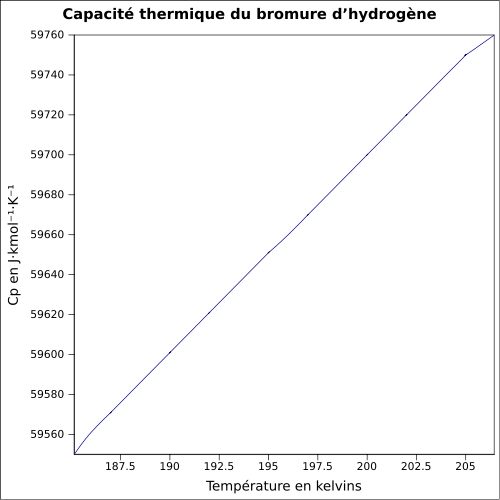
| Cp | 29,1 J/mol·K (25 °C) équation[4] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Danger H314 : Provoque de graves brûlures de la peau et des lésions oculaires H335 : Peut irriter les voies respiratoires | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Gaz comprimé pression absolue à 54,4 °C = 4 130 kPa D1A : Matière très toxique ayant des effets immédiats graves Transport des marchandises dangereuses : classe 2.3 E : Matière corrosive Transport des marchandises dangereuses : classe 8 Divulgation à 1,0 % selon la liste de divulgation des ingrédients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
0 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalation | toxique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peau | Très corrosif | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yeux | Très corrosif | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 2 ppm[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le bromure d’hydrogène, de symbole chimique HBr, est un gaz incolore toxique et hautement corrosif, qui forme des fumées blanches au contact de l’humidité. Ces fumées sont constituées d’acide bromhydrique, qui se forme lorsque le bromure d’hydrogène est dissous dans l’eau. Le bromure d’hydrogène est un produit chimique assez utilisé en chimie, dans l’industrie ou dans les laboratoires. Le nom HBr se réfère parfois de manière impropre à l’acide bromhydrique au lieu du bromure d’hydrogène gazeux. Les chimistes parlent également d'acide bromhydrique gazeux ou anhydre pour se référer au bromure d'hydrogène.
Histoire
Le bromure d'hydrogène a été étudié et préparé par le chimiste Antoine-Jérôme Balard lors de sa découverte du brome dans les marais salants près de Montpellier.
Chimie
La molécule de bromure d’hydrogène HBr est une molécule diatomique constituée d’un atome d’hydrogène H et d'un atome de brome Br, liés par une liaison covalente simple. Le brome étant plus électronégatif que l’hydrogène, la liaison est polarisée. En conséquence, la molécule porte un moment dipolaire, avec une charge partielle négative δ- portée par l’atome de brome et une charge partielle positive δ+ portée par l’atome d’hydrogène. Le bromure d’hydrogène est donc une molécule polaire et est très soluble dans l’eau et dans les solvants polaires. Les solutions d'acide bromhydrique sont saturées avec 68,85 % de HBr en poids. À température ambiante, le bromure d'hydrogène est un gaz à odeur âcre, fumant dans l'air humide à cause de la formation d'acide bromhydrique.
Production industrielle
Le bromure d'hydrogène est industriellement produit en petite quantité par rapport au chlorure d'hydrogène et à l'acide chlorhydrique qui sont des produits majeurs de l'industrie chimique. La préparation la plus courante de HBr se fait en mélangeant du dihydrogène et du dibrome à haute température (200 à 400 °C). La réaction est généralement catalysée par du platine.
Synthèse du bromure d'hydrogène
La préparation de HBr se fait à l'aide de nombreuses méthodes.
Une synthèse très simple utilise la réaction entre l'acide sulfurique et le bromure de sodium :
- NaBr(s) + H2SO4(aq) → NaHSO4(s) + HBr(g)
Cependant cette synthèse n'a pas un bon rendement car le bromure d'hydrogène formé est oxydé en dibrome par l'acide sulfurique :
- 2HBr(g) + H2SO4(aq) → Br2(g) + SO2(g) + 2H2O(l)
Pour cette méthode, des acides non oxydants comme l'acide acétique ou l'acide phosphorique peuvent être utilisés.
La réduction du dibrome par l'acide phosphoreux ou par le dioxyde de soufre permet aussi d'obtenir HBr :
- Br2 + H3PO3 + HO− → H2PO4−(s) + 2HBr(g)
- Br2 + SO2 + 2H2O → H2SO4 + 2HBr(g)
Enfin, l'hydrolyse des bromures métalliques permet de former du bromure d'hydrogène, simplement humide et souillé par des traces de corps ayant pris part à la réaction avec un bon rendement. C'est un procédé couramment employé.
Le bromure d'hydrogène entraîne toujours des vapeurs d'eau de dibrome. Ces dernières sont éliminées par une pâte de phosphore rouge et d'eau ou d'acide bromhydrique, rendu perméable par de petits fragments de tube de verre. Sec et sans dibrome, le gaz n'attaque plus le caoutchouc.
Utilisations
Le bromure d'hydrogène a de nombreuses utilisations dans la synthèse de produits organiques.
Par exemple, il est utilisé pour produire des bromures d'alkyle à partir d'alcools :
- ROH + HBr → R+OH2 + Br− → RBr + H2O
Il est ajouté aux alcènes pour donner des bromoalcanes :
- RCH=CH2 + HBr → RCH(Br)–CH3
Il est additionné aux alcynes pour former des bromoalcènes. La stéréochimie de ce type d'addition est anti :
- RC≡CH + HBr → RCH(Br)=CH2
Il est ajouté aux halogénoalcènes pour former un dihalogénoalcane géminal. Ce type d'addition suit la règle de Markovnikov :
- RC(Br)=CH2 + HBr → RC(Br2)–CH3
Aussi le bromure d'hydrogène est utilisé pour ouvrir des époxydes et des lactones ainsi que dans la synthèse de bromoacétals. Et pour finir le bromure d'hydrogène est un catalyseur pour de nombreuses réactions organiques.
Sécurité
Le bromure d'hydrogène réagit avec la plupart des métaux en présence d'humidité et forme du dihydrogène, un gaz très inflammable. La réaction avec les bases peut être très violente. Il réagit aussi avec l'eau pour former de l'acide bromhydrique, un acide fort. Ce produit ne doit pas être rejeté dans l'environnement car il provoque un changement de pH des eaux. En mélange avec de l'eau, il provoque une corrosion rapide. Le bromure d'hydrogène est un gaz plus lourd que l'air et il peut s'accumuler sous le sol ou dans des endroits confinés. Dans une atmosphère humide il se dégage des vapeurs blanches.
Liens externes
Fiche de sécurité complète
Voir aussi
Sur les autres projets Wikimedia :
- bromure d’hydrogène, sur le Wiktionnaire
Références
- ↑ a b c d e et f BROMURE D'HYDROGENE, Fiches internationales de sécurité chimique
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b et c (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- ↑ « Properties of Various Gases », sur flexwareinc.com (consulté le )
- ↑ (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- ↑ Numéro index 035-002-00-0 dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Bromure d'hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ « Hydrogen bromide », sur hazmap.nlm.nih.gov (consulté le )
v · m | |
|---|---|
| Bromures Br(-I) |
|
| Br(I) | |
| Br(III) |
|
| Br(IV) |
|
| Br(V) |
|
| Br(VII) |
|
v · m | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hydrures alcalins (groupe 1) | |||||||||||||||||||||||||
| Hydrures alcalino-terreux (groupe 2) |
| ||||||||||||||||||||||||
| Hydrures du groupe 13 |
| ||||||||||||||||||||||||
| Hydrures du groupe 14 |
| ||||||||||||||||||||||||
| Hydrures de pnictogène (groupe 15) |
| ||||||||||||||||||||||||
| Chalcogénures d'hydrogène (groupe 16) |
| ||||||||||||||||||||||||
| Halogénures d'hydrogène (groupe 17) | |||||||||||||||||||||||||
| Hydrures de métal de transition |
| ||||||||||||||||||||||||
| Hydrures de lanthanide |
| ||||||||||||||||||||||||
| Hydrures d'actinide |
| ||||||||||||||||||||||||
| Exotiques |
| ||||||||||||||||||||||||
 Portail de la chimie
Portail de la chimie