Base non nucléophile
Une base non nucléophile est une base organique dont la nucléophilie est faible relativement aux bases le plus souvent employées. Elles sont utilisées pour obtenir une déprotonation dans les cas où l'introduction d'un composé nucléophile provoquerait des réactions secondaires non souhaitées. La caractéristique de ces bases est l'encombrement stérique autour du centre basique qui empêche l'approche d'un électrophile bien que les effets électroniques existent.
Bases non nucléophiles courantes
Bases aminées
Plusieurs amines et hétérocycles azotés sont utilisés comme composés modérément basiques (pKa de l'acide conjugué d'environ 10-13)
- N,N-Diisopropyléthylamine, ou DIPEA[1]
- 1,8-Diazabicyclo[5.4.0]undéc-7-ène, ou DBU
- 2,6-Di-tert-butylpyridine[2]
Phosphazènes et bases de Verkade
Certains phosphazènes et les bases de Verkade sont des bases phosphorées non ioniques très fortes et très peu nucléophiles[3].
- t-Bu-P4[4]
Bases anioniques et hydrures
Les bases non nucléophiles fortes sont généralement des anions ou des hydrures dont le pKa de l'acide conjugué est de l'ordre de 35-40 (17 pour les alcoolates) :
- Diisopropylamidure de lithium, ou LDA
- Amidures silylés, comme le bis(triméthylsilyl)amidure de sodium ou le bis(triméthylsilyl)amidure de potassium (NaHMDS et KHMDS, respectivement)
- L'hydrure de sodium ou l'hydrure de potassium
- tert-Butylate de potassium, ou tBuOK.
Exemple
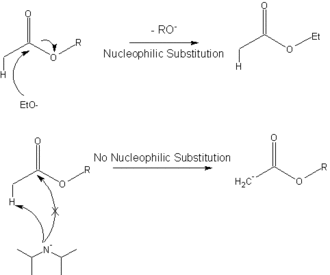
Dans l'exemple ci-dessous, le LDA est utilisé pour déprotoner un ester au lieu de s'additionner sur la fonction ester, comme ce serait le cas avec un éthanolate.
Références
- ↑ K. L. Sorgi, "Diisopropylethylamine," Encyclopedia of Reagents for Organic Synthesis, 2001. DOI 10.1002/047084289X.rd254
- ↑ Rafael R. Kostikov, Sánchez-Sancho Francisco, María Garranzo and M. Carmen Murcia "2,6-Di-t-butylpyridine" Encyclopedia of Reagents for Organic Synthesis 2010. DOI 10.1002/047084289X.rd068.pub2
- ↑ "Strong and hindered bases in organic synthesis", ChemFiles 2003, 3(1), Sigma-Aldrich. PDF.
- ↑ Activation in anionic polymerization: Why phosphazene bases are very exciting promoters S. Boileau, N. Illy Prog. Polym. Sci., 2011, 36, 1132-1151, DOI 10.1016/j.progpolymsci.2011.05.005
v · m Acides et bases | |
|---|---|
| Acidité et basicité |
|
| Théories des acides et des bases | |
| Types d'acide | |
| Types de base |
|
 Portail de la chimie
Portail de la chimie











