Historia de la termodinámica

La historia de la termodinámica es una pieza fundamental en la historia de la física, la historia de la química, y la historia de la ciencia en general. Debido a la relevancia de la termodinámica en muchas áreas de la ciencia y la tecnología, su historia está finamente tejida con los desarrollos de la mecánica clásica, mecánica cuántica, magnetismo, y la cinética química, para aplicar a campos más distante tales como la meteorología, teoría de información, y biología (fisiología), y a desarrollos tecnológicos como la máquina de vapor, motor de combustión interna, criogenia y generación de electricidad. El desarrollo de la termodinámica fue motivado y dirigido por la teoría atómica. También, aunque de una manera sutil, motivó nuevas direcciones en probabilidad y estadística; vea, por ejemplo, la línea de tiempo de la termodinámica.
La historia de la termodinámica como disciplina científica se considera generalmente que comienza con Otto von Guericke quien, en 1650, construyó y diseñó la primera bomba de vacío y demostró las propiedades del vacío usando sus hemisferios de Magdeburgo. Guericke fue impulsado a hacer el vacío con el fin de refutar la suposición de Aristóteles que «la naturaleza aborrece el vacío». Poco después de Guericke, el físico y químico Robert Boyle estudió y mejoró los diseños de Guericke y en 1656, en coordinación con el científico Robert Hooke, construyó una bomba de aire. Con esta bomba, Boyle y Hooke observaron una correlación entre la presión, temperatura y volumen. Con el tiempo, se formularon la ley de Boyle, indicando que para un gas a temperatura constante, la presión y el volumen son inversamente proporcionales y otras leyes de los gases.
En 1679, un asociado de Boyle, Denis Papin basándose en estos conceptos, construyó un digestor de vapor, que era un recipiente cerrado con una tapa de cierre hermético en el que el vapor confinado alcanzaba una alta presión, aumentando el punto de ebullición y acortando el tiempo de cocción de los alimentos.
En 1697, el ingeniero Thomas Savery, a partir de los diseños de Papin, construyó el primer motor térmico, seguido por Thomas Newcomen en 1712. Aunque estos primeros motores eran toscos y poco eficientes, atrajeron la atención de los científicos más destacados de la época.
En 1733, Bernoulli usó métodos estadísticos, junto con la mecánica clásica, para extraer resultados de la hidrodinámica, iniciando la física estadística.
En 1781 los conceptos de capacidad calorífica y calor latente, fueron desarrollados por el profesor Joseph Black de la Universidad de Glasgow, donde James Watt trabajó como fabricante de instrumentos. Watt consultó con Black en las pruebas de la máquina de vapor, pero fue Watt quien concibió la idea del condensador externo, aumentando grandemente la eficiencia de la máquina de vapor.
En 1783, Antoine Lavoisier propone la teoría calórica.
En 1798 Benjamin Thompson, conde de Rumford, demostró la conversión del trabajo mecánico en calor.

Sobre la base de todo este trabajo previo, Sadi Carnot, el «padre de la termodinámica», publicó en 1824 Reflexiones sobre la energía motriz del fuego, un discurso sobre la eficiencia térmica, la energía, la energía motriz y el motor. El documento describe las relaciones básicas energéticas entre la máquina de Carnot, el ciclo de Carnot y energía motriz, marcando el inicio de la termodinámica como ciencia moderna.
El primer libro de texto sobre termodinámica fue escrito en 1859 por William Rankine, quien originalmente se formó como físico y profesor de ingeniería civil y mecánica en la Universidad de Glasgow. El primer y segundo principios de termodinámica surgieron simultáneamente en la década de 1850, principalmente por las obras de Germain Henri Hess, William Rankine, Rudolf Clausius, James Prescott Joule y William Thomson (Lord Kelvin).
Los fundamentos de la termodinámica estadística se establecieron por los físicos como James Clerk Maxwell, Ludwig Boltzmann, Max Planck, Rudolf Clausius, Johannes van der Waals y Josiah Willard Gibbs.
Desde 1873 hasta el 76, el físico matemático estadounidense Josiah Willard Gibbs publicó una serie de tres artículos, siendo la más famosa Sobre el equilibrio de las sustancias heterogéneas. Gibbs demostró cómo los procesos termodinámicos, incluyendo reacciones químicas, se podrían analizar gráficamente. Mediante el estudio de la energía, la entropía, potencial químico, la temperatura y la presión del sistema termodinámico, se puede determinar si un proceso se produce espontáneamente. La termodinámica química y la fisicoquímica fueron desarrolladas además por Walther Nernst, Pierre Duhem, Gilbert N. Lewis, Jacobus Henricus van 't Hoff, y Théophile de Donder, entre otros, aplicando los métodos matemáticos de Gibbs.
También fueron de importancia para la termodinámica los desarrollos en termometría y manometría.
Historia
Contribuciones de tiempos ancestrales y medievales
Los ancestros vieron el calor como algo relacionado al fuego. En el año 3000 antes de Cristo, los egipcios antiguos vieron al calor como algo relacionado con orígenes mitológicos.[1] En la tradición filosófica Occidental, después de mucho debate sobre el elemento primordial entre los principales filósofos presocráticos, Empédocles propuso una teoría de cuatro elementos, en la cual todas las sustancias derivan de la tierra, agua, aire, y fuego. El elemento Empedocleano del fuego es quizás el principal antecesor de conceptos posteriores tales como flogisto y caloría. Alrededor del año 500 AC, el filósofo griego Heráclito fue conocido como el «flux y fuego» filósofo debido a su expresión proverbial: «Todas las cosas están fluyendo». Heráclito argumentó que los tres elementos principales en naturaleza eran fuego, tierra, y agua.
El atomismo es una parte central de la actual relación entre la termodinámica y física estadística. Los antiguos pensadores tales como Leucipo y Demócrito, después los Epicúreanos, advirtiendo el atomismo, pusieron las bases para la posterior teoría atómica[la cita necesitada]. Hasta que las pruebas experimentales confirmaron la existencia de los átomos en el siglo XX, la teoría atómica estuvo conducida en gran parte por consideraciones filosóficas e intuición científica.
En el s. V a. C., el filósofo griego Parménides, en su único trabajo del que se sabe, un poema convencionalmente titulado Sobre la Naturaleza, utiliza razonamiento verbal para postular que un hueco, esencialmente lo que ahora se conoce como un vacío, en la naturaleza no podría ocurrir. Esta opinión fue apoyada por los argumentos de Aristóteles, pero fue criticado por Leucipo y Herón de Alejandría. Desde la antigüedad hasta la Edad Media se presentaron diversos argumentos para aprobar o refutar la existencia de un vacío y se hicieron varios intentos para construir un vacío, pero todos resultaron infructuosos.
Los científicos europeos Cornelius Drebbel, Robert Fludd, Galileo Galilei y Santorio Santorio en los siglos XVI y XVII fueron capaces de medir la relación «frío» o «calor» del aire, utilizando un termómetro de aire rudimentario (o termoscopio). Esto puede haber sido influido por un dispositivo más temprano el cual podría expandir y contraer el aire construido por Filón de Bizancio y Herón de Alejandría.
Alrededor del año 1600, el filósofo inglés y científico Francis Bacon conjeturó: «El calor en sí, su esencia y quididad es movimiento y nada más». En 1643, Galileo Galilei, mientras generalmente la aceptación de la «succión» explicación de horror vacui propuesto por Aristóteles, creyó que la naturaleza aborrece el vacío está limitado. Las bombas que operan en minas ya habían demostrado que la naturaleza solo llenaría un vacío con agua hasta una altura de 30 ~pies. Sabiendo este hecho curioso, Galileo animó a su antiguo alumno Evangelista Torricelli para investigar estas limitaciones supuestas. Torricelli no creyó que la naturaleza aborrece el vacío (Horror vacui) en el sentido de Aristóteles la «succión», era responsable de levantar el agua. Más bien, razonó, que era el resultado de la presión ejercida sobre el líquido por el aire circundante.
Para probar esta teoría, llenó un tubo largo de vidrio (sellado en un extremo) con mercurio y lo volcó en un plato que también contenía mercurio. Solo una parte del tubo estaba vacía; ~30 pulgadas del líquido quedaron. Cuando el mercurio vaciado, y un vacío parcial estuvo creado en la parte superior del tubo. La fuerza de la gravedad sobre el elemento pesado mercurio impidió rellenar el vacío.
Transición de la química a termoquímica
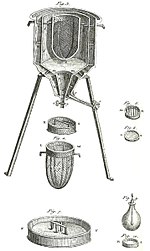
La teoría de flogisto surgió en el siglo XVII, al final del período de la alquimia. Su sustitución por la teoría calórica en el siglo XVIII es uno de los marcadores históricos de la transición de la alquimia a la química. Flogisto era una sustancia hipotética que presumía ser liberada de sustancias combustibles durante la combustión, y de los metales durante el proceso de oxidación. La caloría, como el flogisto, también presumía ser la «sustancia» del calor que se derivaría de un cuerpo caliente a un cuerpo más frío calentándolo.
Los primeros retos experimentales sustanciales a la teoría calórica surgieron en la obra de Rumford 1798, cuando demostró que los cañones de hierro fundido producen grandes cantidades de calor los que atribuyó a la fricción, y su trabajo fue de los primeros en socavar la teoría calórica. El desarrollo de la máquina de vapor también centró la atención en la calorimetría y la cantidad de calor producido a partir de diferentes tipos de carbón. La primera investigación cuantitativa sobre los cambios de calor durante reacciones las químicas se inició por Lavoisier que utilizado un calorímetro de hielo después de la investigación de Joseph Black en el calor latente de agua.
Más estudios cuantitativos por James Prescott Joule en 1843 presentaron más adelante fenómenos profundamente reproducibles, y ayudaron a colocar el tema de la termodinámica sobre una base sólida. William Thomson, por ejemplo, todavía estaba tratando de explicar las observaciones de Joule dentro de un marco calórico en 1850. La utilidad y el poder explicativo de la teoría cinética, sin embargo, pronto comenzaron a desplazar a la teoría calórica y era en gran medida obsoleta a finales del siglo XIX. Joseph Black y Lavoisier hicieron contribuciones importantes en la medición precisa de los cambios de calor utilizando el calorímetro, un tema que se conoció como la termoquímica.
La termodinámica fenomenológica

- La ley de Boyle (1662)
- La ley de Charles fue publicado por primera vez por Joseph Louis Gay-Lussac en 1802, pero hace referencia a trabajos no publicados por Jacques Charles alrededor de 1787. La relación había sido anticipada por el trabajo de Guillaume Amontons en 1702.
- La ley de Gay-Lussac (1802)
Nacimiento de la termodinámica como ciencia
En sus orígenes, la termodinámica era el estudio de motores. Un precursor del motor estuvo diseñado por el científico alemán Otto von Guericke quien, en 1650, diseñó y construyó la primera bomba de vacío y creó por primera vez vacío conocido como los Hemisferios de Magdeburgo. Fue conducido a realizar un vacío con el fin de refutar la suposición de Aristóteles de que la naturaleza aborrece el vacío.
Poco después, el físico y químico irlandés Robert Boyle había aprendido de los diseños de Guericke y en 1656, en coordinación con el científico inglés Robert Hooke, construyó una bomba de aire. Utilizando esta bomba, Boyle y Hooke notaron la correlación de presión-volumen : P.V=constante. En aquel momento, se asumió que el aire es un sistema de partículas inmóviles, y no se interpreta como un sistema de moléculas en movimiento. El concepto de movimiento térmico se produjo dos siglos más tarde. Por lo tanto la publicación de Boyle en 1660 habla sobre un concepto mecánico: la cámara de aire.[2] Más tarde, después de la invención del termómetro, la propiedad llamada temperatura podría ser cuantificada. Esta herramienta dio a Gay-Lussac la oportunidad de derivar su ley, lo que condujo poco después a la ley de los gases ideales. Pero, ya antes del establecimiento de la ley de los gases ideales, un socio de Boyle llamado Denis Papin construyó en 1679 un digestor de hueso, que es un recipiente cerrado con una tapa hermética que confina el vapor hasta que se genera una alta presión.
Los diseños más tardíos implementaron una válvula de escape de vapor para evitar la explosión de la máquina. Al observar la válvula rítmicamente moverse hacia arriba y hacia abajo, Papin concibió de la idea de un pistón y motor de cilindro. Él no obstante sigue adelante con su diseño. Sin embargo, en 1697, basado en los diseños de Papin, el ingeniero Thomas Savery construyó el primer motor. A pesar de que estos primeros motores eran toscos y poco eficientes, atrajeron la atención de los científicos más importantes de la época. Uno de estos científicos fue Sadi Carnot, el «padre de termodinámica», quien en 1824 publicó Reflexiones sobre la potencia motriz del fuego, un discurso sobre el calor, poder, y la eficiencia del motor. Esto marca el inicio de la termodinámica como ciencia moderna.

Por lo tanto, antes de 1698 y la invención de la máquina de vapor, los caballos fueron utilizados para poleas eléctricas, unidos a los cubos, el cual elevó agua fuera de las minas de sal inundadas en Inglaterra. En los años a seguir, se construyeron más variaciones de las máquinas de vapor, como la máquina de Newcomen, y más tarde la máquina de vapor de vatio. Con el tiempo, estos motores tempranos finalmente serían utilizados en lugar de caballos. Así, cada motor empezó a ser asociado con una cierta cantidad de «caballos de potencia» dependiendo de la cantidad de caballos que había reemplazado. El problema principal con estos primeros motores era que eran lentos y torpes, convirtiendo menos de 2 % del combustible de entrada a trabajo útil. En otras palabras, cantidades grandes de carbón (o madera) tuvieron que ser quemados para ceder solo una fracción pequeña de producción de trabajo. De ahí nació la necesidad de una nueva ciencia de la dinámica del motor.

La mayoría citan el libro de Sadi Carnot 1824 Reflexiones sobre la potencia motriz del fuego como el punto de partida para termodinámica como ciencia moderna. Carnot definió «Fuerza motriz» para ser la expresión del efecto útil que un motor es capaz de producir. En esta, Carnot nos presentó a la primera definición moderna de «trabajo»: peso levantado a través de una altura. El deseo de entender, vía formulación, este efecto útil en la relación a «trabajo» es el núcleo de toda la termodinámica moderna.
En 1843, James Joule encontró experimentalmente encontrado el equivalente mecánico de calor. En 1845, el Joule informó su mejor-experimento sabido, implicando el uso de un peso en descenso para hacer girar una rueda de paletas en un barril de agua, el cual le permitió estimar un equivalente mecánico de calor de 819 ft·lbf/Btu (4.41 J/cal). Esto condujo a la teoría de conservación de energía y explicar por qué el calor se convertir en trabajo.
En 1850, el famoso físico matemático Rudolf Clausius definió el término entropía S siendo el calor que se pierde o se convierte en residuos, derivada de la palabra griega entrepein palabra que significa a su vez para girar.
El nombre «termodinámica», sin embargo, no llegó hasta que 1854, cuándo el matemático y físico británico William Thomson (Lord Kelvin) acuñó el término termo-dinámica en su artículo Sobre la Teoría Dinámica del Calor.[3]
En asociación con Clausius, en 1871, el matemático y físico escocés James Clerk Maxwell formulando una nueva rama de la termodinámica llamada termodinámica estadística, que funciona para analizar un gran número de partículas en el equilibrio, es decir, los sistemas donde no hay cambios, de manera que solo sus propiedades medias como temperatura T, presión P, y volumen V se convierten en importantes.
Poco después, en 1875, el físico austriaco Ludwig Boltzmann formuló una conexión precisa entre entropía S y movimiento molecular:
Definiéndose en términos del número de estados posibles [W] que tal movimiento podría ocupar, en donde K es la constante de Boltzmann.
El año siguiente, 1876, era un punto fundamental en el desarrollo del pensamiento humano. Durante este período esencial, el ingeniero químico Willard Gibbs, la primera persona en Estados Unidos en recibir un doctorado en ingeniería (de Yale), publicó un documento de 300 páginas oscuras titulado: Sobre el equilibrio de sustancias heterogéneas, en el que formuló una gran igualdad, la ecuación de energía libre de Gibbs, que sugirió una medida de la cantidad de «trabajo útil» alcanzable en sistemas de reacción. Gibbs también originó el concepto que hoy conocemos como entalpía H, llamándolo «una función de calor de presión constante».[4] La palabra moderna entalpía se acuñó muchos años más tarde por Heike Kamerling Onnes,[5] que se basa en la palabra griega enthalpein cuyo significado es calentar.
A partir de estas bases, aquellos que Lars Onsager, Erwin Schrödinger, y Ilya Prigogine, y otros, funcionando para llevar estos motores de «conceptos» en la vía de casi todas las ramas de hoy en día de la ciencia.
Teoría cinética
La idea de que el calor es una forma de movimiento es quizás antigua y es ciertamente hablado por Francis Bacon en 1620 en su obra Novum Organum. La primera reflexión científica escrita de la naturaleza microscópica del calor es probablemente para ser encontrado en un trabajo por Mikhail Lomonosov, en la que escriba:
- «(…) El movimiento no debe ser negado basado en el hecho de que no se ve. ¿Quién negaría que las hojas de los árboles se mueven cuando crujían por el viento, a pesar de ser observable desde grandes distancias? Al igual que en este caso el movimiento permanece oculto debido a la perspectiva, que permanece oculto en cuerpos calientes debido a los extremadamente pequeños tamaños de las partículas que se mueven. En ambos casos, el ángulo de visión es tan pequeño que ni el objeto ni su movimiento pueden ser vistos».
Durante los mismos años, Daniel Bernoulli publicó su libro Hidrodinámica(1738), en el cual se deriva una ecuación para la presión de un gas teniendo en cuenta las colisiones de los átomos con las paredes de un recipiente. Él demuestra que esta presión es de dos tercios de la energía cinética media de los gases en una unidad de volumen. Las ideas de Bernoulli, sin embargo, poco impacto en la cultura dominante de calorías. Bernoulli establece una conexión con el principio de la fuerza viva de Gottfried Leibniz, una primera formulación del principio de conservación de la energía, y las dos teorías se entrelazó íntimamente a lo largo de su historia. Aunque Benjamin Thompson sugirió que el calor era una forma de movimiento como resultado de sus experimentos en 1798, no se hizo ningún de reconciliar los enfoques teóricos y experimentales, y es poco probable que él estuviera pensando en el principio de la fuerza viva.
John Herapath formuló posteriormente de forma independiente una teoría cinética en 1820, pero utilizando la temperatura como un impulso en lugar de la fuerza viva o energía cinética por error asociado. Su trabajo no fue en última instancia de revisión por pares y fue descuidada. John James Waterston en 1843 proporcionó una cuenta en gran medida exacta, siempre de manera independiente, pero su trabajo recibió la misma recepción, a falta de revisión por pares, incluso de alguien tan bien dispuesto al principio cinético como Davy.
Nuevos avances en la teoría cinética no comenzaron hasta mediados del siglo XIX, con las obras de Rudolf Clausius, James Clerk Maxwell y Ludwig Boltzmann. En su trabajo de 1857 Sobre la naturaleza del movimiento llamado calor, Clausius por primera vez establece claramente que el calor es la energía cinética media de las moléculas. Este interés que Maxwell, en 1859 derivó la distribución de los impulsos más adelante que lleva su nombre.
Boltzmann posteriormente generalizó su distribución para el caso de los gases en los campos externos. Boltzmann es quizás el factor que más contribuye a la teoría cinética, mientras presentaba muchos de los conceptos fundamentales de la teoría. Además de la distribución de Maxwell-Boltzmann que se ha mencionado anteriormente, también asocia la energía cinética de las partículas con sus grados de libertad. La ecuación de Boltzmann para la función de distribución de un gas en los estados de no equilibrio sigue siendo la ecuación más eficaz para el estudio de fenómenos de transporte en gases y metales. Al introducir el concepto de probabilidad termodinámica como el número de microestados que corresponden al micro estado actual, demostró que su logaritmo es proporcional a la entropía.
Ramas de la termodinámica
La siguiente lista recoge las principales ramas de la termodinámica y una fecha aproximada de cuándo se iniciaron:
- Termoquímica (1780)
- Termodinámica clásica (1824)
- Termodinámica química (1876)
- Mecánica estadística (c. 1880)
- Termodinámica del equilibrio
- Ingeniería termodinámica
- Termodinámica de ingeniería química (c. 1940)
- Termodinámica del no equilibrio (1941)
- Termodinámica biológica (1957)
- Termodinámica de los ecosistemas (1959)
- Termodinámica de sistemas pequeños (1960)
- Termodinámica relativista (1965)
- Termodinámica cuántica (1968)
- Termodinámica de los agujeros negros (c. 1970)
- Termodinámica geológica (c. 1970)
- Termodinámica de evolución biológica (1978)
- Termodinámica geoquímica (c. 1980)
- Termodinámica atmosférica (c. 1980)
- Termodinámica de sistemas naturales (1990)
- Termodinámica supramolecular (1990)
- Termodinámica de terremoto (2000)
- Fármaco-termodinámica de receptor (2001)
- Termodinámica de sistemas farmacéuticos (2002)
Las ideas de la termodinámica se han aplicado también en otros campos, por ejemplo:
- Termoeconomía (c. 1970)
Entropía y la segunda ley
A pesar de que estaba trabajando con la Teoría calórica, Sadi Carnot en 1824 sugirió que algunas de las calorías disponibles para generar el trabajo útil se pierden en cualquier proceso real. En marzo de 1851, luchando para llegar a un acuerdo con el trabajo de James Prescott Joule, Lord Kelvin empezó a especular que había una pérdida inevitable de calor útil en todos los procesos. La idea estuvo enmarcada aún más dramáticamente por Hermann von Helmholtz en 1854, dando nacimiento al espectro de la muerte térmica del universo.
En 1854, William John Macquorn Rankine comenzó a utilizar en el cálculo de lo que llamó su función termodinámica. Posteriormente se ha demostrado que es idéntico al concepto de la entropía formulado por Rudolf Clausius en 1865. Clausius utilizó el concepto para desarrollar su declaración clásica del segundo principio de termodinámica el mismo año.
Transferencia de calor
El fenómeno de la conducción de calor se capta inmediatamente en la vida cotidiana. En 1701, Isaac Newton publicó su ley de enfriamiento. Sin embargo, en el siglo XVII, se llegó a creer que todos los materiales tenían una conductividad idéntica y que las diferencias en la sensibilidad surgieron de sus diferentes capacidades caloríficas.
Las sugerencias de que este podría no ser el caso procedían de la nueva ciencia de la electricidad en la que era fácilmente evidente que algunos materiales son buenos conductores eléctricos mientras que otros eran aislantes eficaces. Jan Ingenhousz en 1785-9 hizo algunas de las primeras mediciones, al igual que Benjamin Thompson durante el mismo periodo.
El hecho de que el aire caliente sube y la importancia del fenómeno de la meteorología fue lanzado por primera vez por Edmund Halley en 1686. John Leslie observó que el efecto de enfriamiento de una corriente de aire aumenta con su velocidad, en 1804.
Carl Wilhelm Scheele señaló la transferencia de calor distinguido por radiación térmica (calor radiante) de aquel por convección y conducción en 1777. En 1791, Pierre Prévost mostró que todos los cuerpos irradian calor, qué tan calientes o fríos son. En 1804, Leslie observó que una superficie mate negra irradia calor más eficazmente que una superficie pulida, lo que sugiere la importancia de la radiación del cuerpo negro. Aunque haya devenido para ser sospechado incluso de los trabajos de Scheele , en 1831 Macedonio Melloni demostró que la radiación del cuerpo negro podría ser reflejada, refractada y polarizada en la misma manera como la luz.
James Clerk Maxwell en 1862 la idea de que tanto la luz como el calor radiante eran formas de radiación electromagnética llevando al inicio del análisis cuantitativo de la radiación térmica. En 1879, Jožef Stefan observando que el flujo radiante total a partir de un cuerpo negro es proporcional a la cuarta potencia de su temperatura y se indica la Ley de Stefan-Boltzmann. La ley se derivó teóricamente por Ludwig Boltzmann en 1884.
Criogenia
En 1702 Guillaume Amontons introdujo el concepto del cero absoluto basado en observaciones de gases. En 1810, John Leslie congeló agua a hielo artificialmente. La idea de cero absoluto fue generalizada en 1848 por Lord Kelvin. En 1906, Walther Nernst declaró el tercer principio de termodinámica.
Anexo: Cronología de la termodinámca
Cronología de la termodinámca | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Esta tabla es un extracto de Anexo:Cronología de la termodinámica § Cronología de la termodinámica.[editar]
|
Véase también
- Conservación de la energía: Desarrollo histórico
- Historia de la química
- Historia de la física
- Maxwell's thermodynamic surface
- Timeline of thermodynamics, statistical mechanics, and random processes
- Termodinámica
- Timeline of heat engine technology
- Timeline of low-temperature technology
Referencias
- ↑ J. Gwyn Griffiths (1955). «The Orders of Gods in Greece and Egypt (According to Herodotus)». The Journal of Hellenic Studies 75: 21-23. JSTOR 629164. doi:10.2307/629164.
- ↑ New Experiments physico-mechanicall, Touching the Spring of the Air and its Effects (1660). [1]
- ↑ Thomson, W. (1854). Part V. Thermo-electric Currents. «On the Dynamical Theory of Heat». Transactions of the Royal Society of Edinburgh 21 (part I): 123. doi:10.1017/s0080456800032014.
- ↑ Laidler, Keith (1995). The World of Physical Chemistry. Oxford University Press. p. 110.
- ↑ Howard, Irmgard (2002). «H Is for Enthalpy, Thanks to Heike Kamerlingh Onnes and Alfred W. Porter». Journal of Chemical Education (ACS Publications) 79 (6): 697. Bibcode:2002JChEd..79..697H. doi:10.1021/ed079p697.
- ↑ Lucrecius. «De rerum natura» (en lat).
- ↑ Francis Bacon (1620). The New Organon or true directions concerning the interpretation of nature (en inglés) 2 (XI).
- ↑ Blaise Pascal (1648). Récit de la grande expérience de l'équilibre des liqueurs.
- ↑ Robert Boyle (1682). New experiments physico-mechanical touching the spring of the air, and its effects, made, for the most part, in a new pneumatical engine (en inglés). Richard Davis.
- ↑ Edme Mariotte (1676). Discours de la nature de l'air. Pierre Vander. p. 149.
- ↑ Denis Papin (1691). Mechanicorum de viribus motricibus sentencia (en lat). Acta Eruditorum.
- ↑ Otto von Guericke (1672). Experimenta nova (ut vocantur) Magdeburgica de vacuo spatio (en lat). Apud Joannem Janssonium.
- ↑ In 1662, he published a second edition of the 1660 book New Experiments Physico-Mechanical, Touching the Spring of the Air, and its Effects with an addendum Whereunto is Added a Defence of the Authors Explication of the Experiments, Against the Obiections of Franciscus Linus and Thomas Hobbes; see J Appl Physiol 98: 31–39, 2005. (Jap.physiology.org Online.)
- ↑ "Heat being nothing else but a very brisk and vehement agitation of the parts of a body." Hooke, Robert, Robert (1965). Micrographia. s.l.: Science Heritage. p. 12.
- ↑ Johannes Joachimus Becherus (1669). Physicæ Mediterraneæ (en lat). Ex officina Weidmanniana.
- ↑ Gottfried Leibniz (1686). Brevis demonstratio erroris memorabilis Cartesii et aliorum circa legem naturalem, secundum quam volunt a Deo eandem semper quanti-tatem motus conservari, qua in re mechanica abutuntur (en lat). Acta Eruditorium.
- ↑ Georg Ernst Stahl (1697). Zymotechnia Fundamentalis seu fermentationis theoria generalis, qua noblissimæac subtilissamæ, causæ et effectus in genere, ex-ipsis mechanico-physicis principiis, sumio studio eruuntur... (en lat). Halle.
- ↑ Jenkins, Rhys (1936). Links in the History of Engineering and Technology from Tudor Times. Ayer Publishing. p. 66. ISBN 0-8369-2167-4.
- ↑ Daniel Bernoulli (1738). Hydrodynamica, sive de viribus et motibus fluidorum commentarii. Opus academicum ab auctore, dum petropoli ageret, congestum (en lat). Johannis Rheinholdi Dulsekeri.
- ↑ J. Robison (1803). https://archive.org/download/2543060RX2.nlm.nih.gov/2543060RX2.pdf. Lectures on the Elements of Chemistry by Joseph Black (en inglés). Longman and Rees.
- ↑ ver:
- Daniel Rutherford (1772) "Dissertatio Inauguralis de aere fixo, aut mephitico" (Inaugural dissertation on the air [called] fixed or mephitic), M.D. dissertation, University of Edinburgh, Scotland.
- Traducción al inglés: Leonard Dobbin (1935) "Daniel Rutherford's inaugural dissertation," Journal of Chemical Education, 12 (8) : 370–375.
- Ver también: James R. Marshall and Virginia L. Marshall (Spring 2015) "Rediscovery of the Elements: Daniel Rutherford, nitrogen, and the demise of phlogiston," The Hexagon (of Alpha Chi Sigma), 106 (1) : 4–8. Available on-line at: University of North Texas.
- ↑ Lavoisier, Antoine Laurent (1965). Elements of chemistry, in a new systematic order: containing all the modern discoveries. Courier Dover Publications. p. 15. ISBN 0-486-64624-6.
- ↑ Antoine Lavoisier (1862). Oeuvres de Lavoisier - Réflexions sur le phlogistique : pour servir de développement à la théorie de la combustion et de la calcination 2. Imprimerie Impériale, Paris. pp. 623-624.
- ↑ Pierre Prévost (1788). De l'origine des forces magnétiques. Barde, Manget et Compagnie; Buisson.
- ↑ Benjamin Count of Rumford (1804). «An enquiry concerning the nature of heat and the mode of its communication». Philosophical Transactions of the Royal Society (en inglés) 1: 139-147.
- ↑ John Leslie (1804). An Experimental Inquiry into the Nature and Propagation of Heat (en inglés). Edinburgh: J. Mawman.
- ↑ William Hyde Wollaston (1806). «On the Force of Percussion». Philosophical Transactions of the Royal Society of London (en inglés) 96: 13-22.
- ↑ John Dalton (1808). A New System of Chemical Philosophy I (en inglés). R. Bickerstaff.
- ↑ E. M. Horsburgh (1933). «The Works of Sir John Leslie (1766–1832)». Mathematical Notes (en inglés) 28: i-v. doi:10.1017/S1757748900002279.
- ↑ Alexis Thérèse Petit; Pierre Louis Dulong (1819). gallica «Recherches sur quelques points importants de la théorie de la chaleur». Annales de chimie et de physique 10: 395-413.
- ↑ Joseph Fourier (1822). Théorie analytique de la chaleur. Firmin Didot.
- ↑ Sadi Carnot (1824). Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance. Bachelier.
- ↑ Brown, Robert, 1773-1858. (1828). A brief account of microscopical observations made in the months of June, July, and August, 1827, on the particles contained in the pollen of plants: and on the general existence of active molecules in organic and inorganic bodies .... A. and C. Black. OCLC 38057036.
- ↑ Stephen Gray (1695). «Several Microscopical Observations and Experiments, Made by Mr. Stephen Gray». Philosophical Transactions of the Royal Society of London (en inglés) 19: 280-296.
- ↑ L. Nobili; M. Melloni (1831). «Recherches sur plusieurs phénomènes calorifiques entreprises au moyen du thermo-multiplicateur». Annales de chimie et de physique: 198-218.
- ↑ CLAPEYRON, Benoît Paul Émile. (1834). Mémoire sur la puissance motrice de la chaleur.. OCLC 559435201.
- ↑ J. R. Mayer (1845). Die organische Bewegung in ihrem Zusammenhange mit dem Stoffwechsel (en alemán). Heilbronn.
- ↑ Waterston, John J. (1843). Thoughts on the mental functions : being an attempt to treat metaphysics as a branch of the physiology of the nervous system.. London. OCLC 328092289.
- ↑ «Neglected Pioneers». www.math.umd.edu. Consultado el 20 de diciembre de 2020. «there is no evidence that any physical scientist read the book; perhaps it was overlooked because of its misleading title, Thoughts on the Mental Functions.»
- ↑ Joule, J.P. (1843). «LII. On the calorific effects of magneto-electricity, and on the mechanical value of heat». The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science (en inglés) 23 (154): 435-443. ISSN 1941-5966. doi:10.1080/14786444308644766.
- ↑ Grove, W. R. (1874). The correlation of physical forces (6th edition) by W.R. Grove.. London: Longmans, Green. doi:10.5962/bhl.title.19475.
- ↑ Helmholtz, Hermann v. (1847). Über die Erhaltung der Kraft, eine physikalische Abhandlung. OCLC 488622067.
- ↑ William Thomson (1848). «On an absolute thermometric scale founded on Carnot's theory of the motive power of heat and calculated from Regnaut's observations». Philosophical Magazine (en inglés) 33.
- ↑ William John Macquorn Rankine (1851). «Abstract of a Paper on the Hypothesis of Molecular Vortices, and its Application to the Mechanical Theory of Heat». Proceedings of the Royal Society of Edinburgh (en inglés) 2: 275-288.
- ↑ Rudolf Clausius (1850). «Ueber die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbst ableiten lassen». Annalen der Physik (en alemán) 155 (3): 368-397. doi:10.1002/andp.18501550306.
- ↑ J. P. Joule; W. Thomson (1852). «On the thermal effects experienced by air in rushing through small apertures». Philosophical Magazine. 4 (en inglés) 4 (28): 481-492.
- ↑ August Krönig (1856). «Grundzüge einer Theorie der Gase». Annalen der Physik (en alemán) 2: 315.
- ↑ Rudolf Clausius (1857). «XI. On the nature of the motion which we call heat». Philosophical Magazine. 4 (en inglés) 14 (91): 108-127. doi:10.1080/14786445708642360.
- ↑ J. C. Maxwell (1860). «Illustrations of the dynamical theory of gases.—Part I. On the motions and collisions of perfectly elastic spheres». Philosophical Magazine. 4 (en inglés) 19 (124). doi:10.1080/14786446008642818.
- ↑ Gustav Kirchhoff (1859). «Uber den Zusammenhang zwischen Emission und Absorption von Licht und Wärme». Monatsberichte der Akademie der Wissenschaften zu Berlin (en alemán): 783-787.
- ↑ James Clerk Maxwell (1965). The Scientific Papers of J. C. Maxwell — On the dynamical theory of gases (en inglés) 2. Dover. pp. 26-78.
- ↑ J. C. Maxwell (1871). Theory of Heat (en inglés). Green & Co.
- ↑ R. Clausius (1870). «XVI. On a mechanical theorem applicable to heat». Philosophical Magazine. 4 (en inglés) 40 (265): 122-127. doi:10.1080/14786447008640370.
- ↑ Josef Stefan (1871). «Über das Gleichgewicht und Bewegung, insbesondere die Diffusion von Gemischen». Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften Wien, 2te Abteilung a (en alemán) 63: 63-124.
- ↑ a b Ludwig Boltzmann (1964). Lectures on Gas Theory (en inglés). Dover. ISBN 0-486-68455-5.
- ↑ Johannes Diderik van der Waals (1873). De continuiteit van der gas. En vloeistoftoestand (en nepalí).
- ↑ Pierre Duhem (1886). Le potentiel thermodynamique et ses applications. A. Herman.
- ↑ Willard Gibbs (1899). Équilibre des systèmes chimiques. G. Carré et C. Naud.
- ↑ J. W. Gibbs (1876). «On the equilibrium of heterogeneous substances». Transactions of the Connecticutt Academy (en inglés) 3: 108.
- ↑ Johann Loschmidt (1876). «Über den Zustand des Wärmegleichgewichtes eines Systems von Körpern mit Rücksicht auf die Schwerkraft». Sitzungs berichte Akademie die Wissenschaften in Wien (en alemán) 73: 139.
- ↑ Joseph Stefan (1879). «Über die Beziehung zwischen der Wärmestrahlung und der Temperatur». Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften Wien (en alemán) 73: 391.
- ↑ Ludwig Boltzmann (1884). «Ableitung des Stefan'schen Gesetzes, betreffend die Abhängigkeit der Wärmestrahlung von der Temperatur aus der electromagnetischen Lichttheorie». Annalen der Physik (en alemán) 256 (6): 291-294. doi:10.1002/andp.18842580616.
- ↑ Henry Le Chatelier (1884). «Sur un énoncé général des lois des équilibres chimiques». Comptes-rendus de l’Académie des sciences 99: 786-789.
- ↑ J. H. van 't Hoff (1886). «L'équilibre chimique dans les systèmes gazeux, ou dissous à l'état dilué». Archives néerlandaises des sciences exactes et naturelles 20: 239-302.
- ↑ Wilhelm Wien (1893). «Eine neue Beziehung der Strahlung schwarzer Körper zum zweiten Hauptsatz der Wärmetheorie». Sitzungsberichte der preussischer Akademie (en alemán): 55-62.
- ↑ Pierre Curie (1894). «Sur la symétrie dans les phénomènes physiques, symétrie d'un champ, électrique et d'un champ magnétique». Journal de Physique Théorique et Appliquée 3 (1).
- ↑ Ernst Zermelo (1896). «Über einen Satz der Dynamik und die mechanische Wärmetheorie». Wiedemanns Annalen (en alemán) 296 (3): 485-494. doi:10.1002/andp.18962930314.
- ↑ Planck, Max, 1858-1947. Zur Theorie des Gesetzes der Energieverteilung im Normalspectrum. OCLC 15745309.
- ↑ Gibbs, 1902
- ↑ Albert Einstein (1905). «On a Heuristic Viewpoint Concerning the Production and Transformation of Light». Annalen der Physik (In German).
- ↑ Albert Einstein (1905). «Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen». Annalen der Physik (en alemán) 322 (8): 549-560. ISSN 0003-3804. doi:10.1002/andp.19053220806.
- ↑ Marian Smoluchowski (1906). «Sur le chemin moyen parcouru par les molécules d'un gaz et sur son rapport avec la théorie de la diffusion». Bulletin International de L'Académie de Cracovie 1: 202-213.
- ↑ Albert Einstein (1907). «Plancksche Theorie der Strahlung und die Theorie der Spezifischen Wärme». Annalen der Physik. 4 (en alemán) 22: 180-190.
- ↑ Paul Langevin (1908). Lire en ligne sur Gallica «Sur la théorie du mouvement brownien». Comptes-rendus de l'Académie des Sciences 146: 530-532.
- ↑ Pogliani, Lionello; Berberan-Santos, Mario (2000). «Constantin Carathéodory and the axiomatic thermodynamics». Journal of Mathematical Chemistry 28 (1): 313. S2CID 17244147. doi:10.1023/A:1018834326958. Consultado el 30 de mayo de 2022.
- ↑ Albert Einstein (1910). «Theorie der Opaleszenz von homogenen Flüssigkeiten und Flüssigkeitsgemischen in der Nähe des kritischen Zustandes». Annalen der Physik. 4 (en alemán) 33: 1275-1298.
- ↑ Paul Ehrenfest; Tatiana Ehrenfest (1990). The Conceptual Foundations of the Statistical Approach in Mechanics (en inglés). Dover Inc. ISBN 0-486-66250-0.
- ↑ Debye, Peter (1912). «Zur Theorie der spezifischen Waerme». Annalen der Physik (en alemán) 39 (4): 789-839. Bibcode:1912AnP...344..789D. doi:10.1002/andp.19123441404.
- ↑ Sydney Chapman (1916). «On the law of distribution of molecular velocities, and on the theory of viscosity and thermal conduction, in a non-uniform simple monatomic gas». Philosophical Transactions of the Royal Society A (en inglés) 216: 279-348.
- ↑ David Enskog (1917). Kinetische Theorie der Vorgänge in mässig verdünnten Gasen (en alemán). Université d'Uppsala.
- ↑ Albert Einstein (1916). «Quantentheorie der Strahlung». Mitteilungen der Physikalischen Gesellschaft (en alemán) 16: 47-62.
- ↑ Saha, Megh Nad (1920). «LIII.Ionization in the solar chromosphere». Philosophical Magazine. Series 6 40 (238): 472-488. doi:10.1080/14786441008636148.
- ↑ P. Debye; E. Hückel (1923). «The theory of electrolytes. I. Lowering of freezing point and related phenomena». Physikalische Zeitschrift (en inglés) 24: 185-206.
- ↑ S. N. Bose (1924). «Plancks Gesetz und Lichtquantenhypothese». Zeitschrift für Physik (en alemán) 26 (1): 178-181.
- ↑ Fermi, Enrico (1926). «Sulla quantizzazione del gas perfetto monoatomico». Rendiconti Lincei (en italiano) 3: 145-9. , translated as Zannoni, Alberto (1999-12-14). «On the Quantization of the Monoatomic Ideal Gas». arXiv:cond-mat/9912229.
- ↑ Paul Dirac (1926). «On the Theory of Quantum Mechanics». Proceedings of the Royal Society A 112 (762): 661-77. Bibcode:1926RSPSA.112..661D. JSTOR 94692. doi:10.1098/rspa.1926.0133.
- ↑ Enrico Fermi (1926). «Zur Quantelung des idealen einatomigen Gases». Zeitschrift für Physik (en alemán) 36 (11): 902-912. doi:10.1007/BF01400221.
- ↑ P. A. M. Dirac (1927). «The Quantum Theory of Emission and Absorption of Radiation». Proceedings of the Royal Society (en inglés): 243-265.
- ↑ John von Neumann (1927), «Wahrscheinlichkeitstheoretischer Aufbau der Quantenmechanik», Göttinger Nachrichten 1: 245-272 .
- ↑ Anonymous (1927). «Minutes of the Philadelphia Meeting December 28, 29, 30, 1926». Physical Review 29 (2): 350-373. Bibcode:1927PhRv...29..350.. doi:10.1103/PhysRev.29.350.
- ↑ Johnson, J. (1928). «Thermal Agitation of Electricity in Conductors». Physical Review 32 (97): 97-109. Bibcode:1928PhRv...32...97J. doi:10.1103/physrev.32.97.
- ↑ Nyquist H (1928). «Thermal Agitation of Electric Charge in Conductors». Physical Review 32 (1): 110–113. Bibcode:1928PhRv...32..110N. doi:10.1103/PhysRev.32.110.
- ↑ Onsager, Lars (15 de febrero de 1931). «Reciprocal Relations in Irreversible Processes. I.». Physical Review (American Physical Society (APS)) 37 (4): 405-426. Bibcode:1931PhRv...37..405O. ISSN 0031-899X. doi:10.1103/physrev.37.405.
- ↑ Norbert Wiener (1930). «Generalized Harmonic Analysis». Acta Mathematica (en inglés) 55: 117-258.
- ↑ Alexandre Khintchine (1934). «Korrelationstheorie der stationären stochastischen Prozesse». Mathematische Annalen (en alemán) 109 (1): 604-615. doi:10.1007/BF01449156.
- ↑ Lars Onsager (1931). «Reciprocal Relations in Irreversible Processes. I.». Physical Review (en inglés) 37: 405. doi:10.1103/PhysRev.37.405.
- ↑ Lars Onsager (1931). «Reciprocal Relations in Irreversible Processes. II.». Physical Review (en inglés) 38: 2265. doi:10.1103/PhysRev.38.2265.
- ↑ Johann von Neumann (1932). Mathematische Grundlagen der Quantenmechanik (en alemán) 38. Verlag von Julius Springer.
- ↑ Jacques Yvon (1935). «La théorie statistique des fluides et l’équation d’état». Actualités scientifiques et industrielles (Hermann) (203).
- ↑ Lev Landau (2008). «On the Theory of Phase Transitions». Ukrainian Journal of Physics (en inglés) 53: 25-35.
- ↑ A. A. Vlasov (1938). «On Vibration Properties of Electron Gas». J. Exp. Theor. Phys. (en ruso) 8 (3): 291.
- ↑ A. A. Vlasov (1968). «The Vibrational Properties of an Electron Gas». Soviet Physics Uspekhi 10 (6): 721-733. Bibcode:1968SvPhU..10..721V. S2CID 122952713. doi:10.1070/PU1968v010n06ABEH003709.
- ↑ N. N. Bogolyubov Jr. and D. P. Sankovich (1994). "N. N. Bogolyubov and statistical mechanics". Russian Math. Surveys 49(5): 19—49. doi 10.1070/RM1994v049n05ABEH002419
- ↑ N. N. Bogoliubov and N. M. Krylov (1939). Fokker–Planck equations generated in perturbation theory by a method based on the spectral properties of a perturbed Hamiltonian. Zapiski Kafedry Fiziki Akademii Nauk Ukrainian SSR 4: 81–157 (in Ukrainian).
- ↑ H. A. Kramers (1940). «Brownian Motion in a Field of Force and the Diffusion Model of Chemical Reactions». Physica (en inglés) 7: 284.
- ↑ J. E. Moyal (1949). «Stochastic Processes and Statistical Physics». Journal of the Royal Statistical Society. B (en inglés) 11 (2): 150-210.
- ↑ J. L. Doob (1942). «The Brownian Movement and Stochastic Equations». Annals of Mathematics. 2 (en inglés) 43 (2): 351-369.
- ↑ Erwin Schrödinger (1943). Public Lectures at Trinity College (Dublin) (en inglés).
- ↑ Erwin Schrödinger (1944). What is Life? (en inglés). Cambridge University Press.
- ↑ Léon Brillouin (1956). Science and Information Theory (en inglés). Dover. ISBN 0-486-43918-6.
- ↑ Lars Onsager (1 de febrero de 1944). «Crystal Statistics. I. A Two-Dimensional Model with an Order-Disorder Transition». Physical Review 65 (3–4): 117-149. Bibcode:1944PhRv...65..117O. ISSN 0031-899X. doi:10.1103/physrev.65.117.
- ↑ a b Nikolay Bogoliubov (1946). «Kinetic Equations». Journal of Experimental and Theoretical Physics (en ruso) 16 (8): 691-702.
- ↑ a b Nikolay Bogoliubov (1946). «Kinetic Equations». Journal of Physics USSR 10 (3): 265-274.
- ↑ Hendrik Casimir (1945). «On Onsager's Principle of Microscopic Reversibility». Reviews of Modern Physics (en inglés) 17: 343. doi:10.1103/RevModPhys.17.343.
- ↑ Max Born; Herbert S. Green (1946). «A General Kinetic Theory of Liquids I: The Molecular Distribution Functions». Proceedings of the Royal Society (en inglés). A188: 10-18.
- ↑ John G. Kirkwood (1946). «The Statistical Mechanical Theory of Transport Processes I. General Theory». The Journal of Chemical Physics (en inglés) 14 (3). doi:10.1063/1.1724117.
- ↑ {{Cita libro|autor=Ilya Prigogine| título=Thèse de l'[[Université libre de Bruxelles] — Étude thermodynamique des phénomènes irréversibles| editorial=Dunod| año=1947}}
- ↑ Nikolaï Bogolioubov; Kirill Gurov (1947). «Kinetic equations in quantum mechanics». Journal of Experimental and Theoretical Physics (en inglés) 17 (7): 614-628.
- ↑ Claude E. Shannon (julio de 1948). «A mathematical theory of communication». Bell System Technical Journal (en inglés) 27: 379-423. La referencia utiliza el parámetro obsoleto
|mes=(ayuda) - ↑ Claude E. Shannon (octubre de 1948). «A mathematical theory of communication». Bell System Technical Journal (en inglés) 27: 623-656. La referencia utiliza el parámetro obsoleto
|mes=(ayuda) - ↑ Harold Grad (1949). «On the kinetic theory of rarefied gases». Communications on Pure and Applied Mathematics (en inglés) 2 (4): 331-407. doi:10.1002/cpa.3160020403.
- ↑ D. Levermore (1996). «Moment Closure Hierarchies for Kinetic Theories». Journal of Statistical Physics (en inglés) 23 (5-6): 1021-1065.
- ↑ Herbert B. Callen; Theodore A. Welton (1951). «Irreversibility and Generalized Noise». Physical Review (en inglés) 83 (1): 34-40.
- ↑ Peter Mazur (1952). «Sur les états à production d’entropie minimum dans les systèmes continus». Bulletin de la Classe des sciences de l'Académie royale de Belgique. 5 38: 182-196.
- ↑ Robert W. Zwanzig (1954). «High‐Temperature Equation of State by a Perturbation Method. I. Nonpolar Gases». The Journal of Chemical Physics (en inglés) 22 (8): 1420-1426. doi:10.1063/1.1740409.
- ↑ Hazime Mori (1956). «A Quantum-statistical Theory of Transport Processes». Journal of the Physical Society of Japan (en inglés) 11: 1029-1044.
- ↑ Hazime Mori (1958). «Statistical mechanical theory of transport in fluids». Physical Review (en inglés) 112: 1829-1842.
- ↑ Melville S. Green (1954). «Markoff Random Processes and the Statistical Mechanics of Time-Dependent Phenomena. II. Irreversible Processes in Fluids». Journal of Chemical Physics (en inglés) 22: 398-413. doi:10.1063/1.1740082.
- ↑ Ryogo Kubo (1957). «Statistical-Mechanical Theory of Irreversible Processes. I. General Theory and Simple Applications to Magnetic and Conduction Problems». Journal of the Physical Society of Japan (en inglés) 12: 570-586.
- ↑ A. S. Kompaneets (1956). «The establishment of thermal equilibrium between photons and electrons». Journal of Experimental and Theoretical Physics (en inglés) 31: 876.
- ↑ Kubo, Ryogo (15 de junio de 1957). «Statistical-Mechanical Theory of Irreversible Processes. I. General Theory and Simple Applications to Magnetic and Conduction Problems». Journal of the Physical Society of Japan (en inglés) 12 (6): 570-586. ISSN 0031-9015. doi:10.1143/JPSJ.12.570.
- ↑ Jaynes, E.T. (1957). «Information theory and statistical mechanics». Physical Review 106 (4): 620-630. Bibcode:1957PhRv..106..620J. doi:10.1103/PhysRev.106.620.
- ↑ — (1957). «Information theory and statistical mechanics II». Physical Review 108 (2): 171-190. Bibcode:1957PhRv..108..171J. doi:10.1103/PhysRev.108.171.
- ↑ D. N. Zubarev (1960). «Double-time Green Functions in Statistical Physics». Soviet Physics Uspekhi (en inglés) 3 (3): 320—345.
- ↑ B. D. Coleman; W. Noll (1963). «The thermodynamics of elastic materials with heat conduction and viscosity». Archive for Rational Mechanics and Analysis (en inglés) 63 (1): 167-178. doi:10.1007/BF01262690.
- ↑ G. N. Hatsopoulos; J. N. Keenan (1965). Principles of General Thermodynamics (en inglés). John Wiley & Sons. ISBN 0471359998.
- ↑ Jacob Bekenstein (1973). «Black Holes and Entropy». Physical Review D (en inglés) 7: 2333.
- ↑ A. O. Caldeira; Anthony Leggett (1983). «Quantum tunnelling in a dissipative system». Annals of Physics (en inglés) 149 (2): 374-456.
- ↑ D. Jou; J. Casas-Vázquez; G. Lebon (1988). «Extended irreversible thermodynamics». Reports on Progress in Physics (en inglés) 51: 1105-1179.
- ↑ Adrian Bejan (1996). «Street network theory of organization in nature». Journal of Advanced Transportation (en inglés) 30 (2): 85-107. doi:10.1002/atr.5670300207.
Notas
Otras lecturas
- Cardwell, D.S.L. (1971). From Watt to Clausius: The Rise of Thermodynamics in the Early Industrial Age. London: Heinemann. ISBN 0-435-54150-1.
- Leff, H.S. & Rex, A.F. (eds) (1990). Maxwell's Demon: Entropy, Information and Computing. Bristol: Adam Hilger. ISBN 0-7503-0057-4.
Enlaces externos
- History of Statistical Mechanics and Thermodynamics - Timeline (1575 to 1980) @ Hyperjeff.net
- History of Thermodynamics - University of Waterloo
- Thermodynamic History Notes - WolframScience.com
- Brief History of Thermodynamics - Berkeley [PDF]
- History of Thermodynamics - ThermodynamicStudy.net
- Historical Background of Thermodynamics - Carnegie-Mellon University
- History of Thermodynamics - In Pictures
 Datos: Q2376736
Datos: Q2376736 Multimedia: History of thermodynamics / Q2376736
Multimedia: History of thermodynamics / Q2376736